引用本文:中国抗癌协会肿瘤微创治疗专业委员会, 中国医师协会放射性粒子植入技术专家委员会. 放射性碘-125粒子植入治疗局部晚期分化型甲状腺癌中国专家共识(2023版) [J] . 中华医学杂志, 2023, 103(3) : 149-157. DOI: 10.3760/cma.j.cn112137-20220905-01873. 通信作者:王娟,河北省人民医院肿瘤一科,石家庄 050000,Email:gaozhen67@163.com.
摘要
碘-125粒子植入治疗为不能再次手术、碘-131治疗不可控及不适合靶向治疗的持续或复发甲状腺癌提供了一种可选择的手段,具有疗效确切、安全微创的特点。但由于颈部解剖结构较为复杂,靶区位置多变,使得穿刺路径有限,有时难以满足剂量学要求,也难以达到同质化,严重影响疗效,对该技术的推广带来了巨大的挑战。为提高甲状腺癌综合治疗的水平,更好地规范放射性碘-125粒子植入治疗甲状腺癌的操作技术,由中国抗癌协会肿瘤微创治疗专业委员会、中国医师协会放射性粒子植入技术专家委员会牵头,制定了“放射性碘-125粒子植入治疗局部晚期分化型甲状腺癌中国专家共识2022版”,详细介绍了碘-125粒子治疗分化型甲状腺癌的适应证、禁忌证、植入方式、穿刺路径、术前准备、手术流程、手术难点、不良反应、随访等内容,以便为临床实践提供参考。
近些年来甲状腺癌的发病率不断升高[1]。美国国立癌症研究所“监测、流行病学和结果数据库”(即SEER数据库)显示美国甲状腺癌患者的5年生存率为98.4%[2],我国仅为84.3%[3]。分化型甲状腺癌(differentiated thyroid cancer,DTC)占甲状腺恶性肿瘤的94%[4]。虽然多数DTC经过规范化的手术、碘-131粒子治疗及促甲状腺激素(thyroid-stimulating hormone,TSH))抑制治疗预后较好,但仍有14.9%的患者存在疾病持续进展或复发[5],形成局部晚期DTC,表现为侵犯周围重要结构如喉返神经、气管、食管、喉、颈部大血管、上纵隔或广泛皮肤肌肉,多次反复手术切除,反复修复,不断损伤正常组织,影响器官功能。30%的患者在术后放射性碘-131粒子治疗中发生碘-131抵抗,形成碘难治性DTC[6-7]。2017年加拿大安大略癌症治疗中心(Cancer Care Ontario,CCO)甲状腺癌指南指出[8]:对于有症状的、伴有局部并发症或高危风险的碘难治性DTC,局部治疗应优先于全身治疗。但甲状腺癌对放疗不敏感,且受周围喉、气管、食管、脊髓以及腮腺等正常组织限制,难以达到根治剂量,是临床治疗的难点。
放射性粒子植入已有100多年的历史[9]。1972年美国纪念医院的Whitmore医师完成首例经耻骨入路的粒子植入治疗前列腺癌,形成前列腺癌粒子植入的雏形[10]。后逐渐形成模板联合直肠超声引导经会阴穿刺的标准术式,写入欧美权威指南[11-13]。1998年该技术引入中国,将粒子植入用于头颈、胸、腹盆腔肿瘤的局部治疗,取得良好的临床疗效[14-16]。国内已有多项研究表明粒子植入治疗甲状腺癌疗效确切[17-19],1、2、3、4、5年的局部控制率为92.9%、83.3%、54.6%、45.5%、40%,1、2、3、4、5年总体生存率分别为91%、82%、71%、58%、41%[20]。2019年中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)持续/复发及转移性分化型甲状腺癌诊疗指南中指出碘-125粒子植入为不能再次手术、碘-131治疗不可控及不适合靶向治疗的持续或复发病灶提供了新选择[21],可以快速控制转移淋巴结大小和血清甲状腺球蛋白(Thyroglobulin,Tg)水平[22]。但颈部解剖结构复杂,靶区位置多变,周围血管神经丰富,使得穿刺路径有限,有时难以满足剂量学要求,更难以达到同质化,对该技术的稳步推广带来了巨大的挑战。
为使采用放射性碘-125粒子治疗甲状腺癌患者获益最大化,推动我国临床肿瘤微创发展,提高甲状腺癌综合治疗的水平,更好地规范放射性碘-125粒子植入治疗甲状腺癌的操作技术,由中国抗癌协会肿瘤微创治疗专业委员会、中国医师协会放射性粒子植入技术专家委员会牵头,制定了“放射性碘-125粒子植入治疗局部晚期分化型甲状腺癌中国专家共识(2022版)”,以便为临床实践提供参考。
一、共识形成基础
1. 共识形成过程:本共识由中国抗癌协会肿瘤微创治疗专业委员会,中国医师协会放射性粒子植入技术专家委员会牵头,参与制定本共识专家包括放疗科、外科、介入科、内科、超声科和核医学科医师,形成专家委员会,由笔者完成初稿,后发给各位专家,广泛征求意见,最后集中讨论形成共识。
2. 共识的目的和目标人群:共识的目的是让从事放射性粒子治疗甲状腺癌的医师、物理师、麻醉师和护士等明确职责,了解治疗的适应证和禁忌证,以及技术标准和治疗流程,从而使甲状腺癌患者获益。
3. 文献查找:工作组在PubMed、CNKI、万方数据库等中英文网站上,以“seed implantation and thyroid cancer”“粒子植入甲状腺癌”等为检索词,检索发表于2022年6月之前的所有关于碘-125粒子植入治疗甲状腺癌的文献,并以文献为基础,制定共识。
4. 循证级别:共识采用循证医学等级见表1,证据级别和推荐强度相结合,证据级别可信度从高到低分为A、B、C,推荐强度从强到弱分为1和2。推荐强度主要考虑证据质量、治疗效果、治疗方法简易程度和资源获取等。
5. 资金来源:资金资助主要用于文献检索及会议讨论,保证共识顺利完成。本共识的推荐意见未受资助的影响。
二、放射性碘-125粒子植入治疗甲状腺癌的适应证和禁忌证
1. 适应证:(1)碘难治性DTC;(2)晚期不可手术切除或持续反复复发;(3)高龄不能耐受手术切除;(4)具有可评价的临床病灶,直径≤7 cm;(5)凝血功能正常;(6)卡氏功能状态评分(Karnofsky Performance status,KPS)>60分,预期生存期>3个月。
2. 相对适应证:侵犯周围重要结构如喉返神经、气管、食管、喉、下咽、颈部大血管、神经、纵隔或皮肤肌肉,部分合并疼痛、感染、溃疡等并发症的患者。
3. 禁忌证:(1)恶液质,重要脏器功能严重衰竭者;(2)病灶周围严重感染性及放射性炎症没有很好控制者;(3)有严重出血倾向、血小板<50×109/L和凝血功能严重紊乱者(凝血酶原时间>18 s,凝血酶原活动度<40%);(4)抗凝药物未在粒子植入前停用5~7 d;(5)KPS评分≤60分;(6)预计生存期≤3个月。
三、放射性碘-125粒子植入治疗甲状腺癌剂量参考
1. 处方剂量:术前由三级肿瘤科医师共同商议决定治疗方案后由主治医师勾画靶区并确定处方剂量。有研究报道碘-125粒子植入治疗局部复发难治性甲状腺癌,剂量100~140 Gy,中位处方剂量120 Gy,所有患者均未出现局部复发,未观察到严重的不良事件[20]。碘-125粒子植入治疗甲状腺癌:当肿瘤直径≤3 cm,推荐根治性治疗,剂量120~140 Gy。当肿瘤直径>3 cm时,若为初始行粒子植入术:推荐剂量100~120 Gy。若为经过外照射后复发病灶,推荐剂量80~100 Gy,建议外放疗后2~3个月行粒子植入,周围危及器官如皮肤、食管、气管、血管、神经等在耐受剂量以下。
推荐意见1:碘-125粒子植入治疗甲状腺癌处方剂量应根据肿瘤大小,治疗目的、既往放疗史及间隔时间等决定,并满足周围危及器官受量在耐受剂量以下。(证据级别A,推荐强度1)
2. 吸收剂量:国内外多项研究提出粒子植入术后即刻D90与临床疗效相关[23-24],但影响D90的因素很多,主要包括靶区体积、缩小速度、粒子位置等,粒子植入术后的D90仅仅是基于靶区及粒子位置不变的假设计算的剂量。随着时间的推移,粒子植入术后靶区体积、粒子位置会有明显变化。因此肿瘤的实际吸收剂量与术后验证的D90会有较大差异,术后D90并非肿瘤的实际吸收剂量,因此难以用其精准预测疗效[25]。故王娟等[26]提出粒子植入术后动态剂量验证可能更好地评价疗效和并发症,尤其对于肿瘤≥5 cm者,推荐术后半年每月复查CT,行动态剂量验证。有学者提出D1m、D1e、D1s三指标是根据粒子活度、粒子位置及肿瘤体积变化得出的,在粒子植入术后动态剂量验证过程中,可能比D90有更高的预测疗效的价值[25]。
推荐意见2:术后即刻D90并非肿瘤的实际吸收剂量,其受靶区体积、缩小速度、粒子位置等因素影响。粒子植入术后动态剂量验证可能更好地评价疗效和并发症,尤其对于肿瘤≥5 cm者,建议术后每月行动态剂量验证。(证据级别A,推荐强度1)
3. 粒子活度:结合国内外报道[27-31],2021年国内学者[32]提出将粒子活度分为3级,低(0.3~0.4 mCi)、中(0.5~0.6 mCi)、高(0.7~0.8 mCi)。研究[33]报道不同活度碘-125粒子植入后,高活度组粒子靶区内的最高剂量点高于低活度组,且高剂量区持续时间长于低活度组。粒子植入活度与体积、危及器官距离、剂量、冷热点等息息相关,一般肿瘤<5 cm适当降低粒子活度,当肿瘤直径≥5 cm时,可将较高活度粒子分次植入靶区。虽然较高活度粒子可能造成靶区内剂量分布不均匀,但是较高活度粒子的应用可提高靶区单位体积的活度,进而提高剂量率,对治疗肿瘤≥5 cm有一定优势,一定程度上避免大肿瘤内剂量学“冷点”存在,对提高肿瘤局部控制率有一定优势。靶区与危及器官距离不同,粒子活度的选择也不同,如肿瘤距离食管、气管、血管、神经及皮肤<1 cm,推荐活度0.3~0.6 mCi;如肿瘤表面伴有溃疡,推荐活度0.3~0.4 mCi。如肿瘤中心伴液化坏死,推荐粒子活度0.4~0.6 mCi,分次植入。
推荐意见3:粒子植入活度选择需综合考虑靶区位置、肿瘤大小、危及器官距离、肿瘤质地等因素。对于体积小、分化差、距危及器官距离近的靶区降低粒子活度;当肿瘤直径≥5 cm时,可将较高活度粒子分次植入靶区。(证据级别B,推荐强度1)
四、放射性碘-125粒子治疗甲状腺癌植入方式
目前甲状腺癌粒子植入影像引导方式包括CT、超声,根据不同穿刺路径又可以采用徒手植入、3D打印模板植入、平面模板穿刺等不同的引导方式。
1. 徒手植入:徒手穿刺适用于表浅肿瘤,优势在于可任意调控针走行方向,较灵活,避开重要器官、组织,特别是活动度较大病灶,粒子植入针插植时要掌握一定的穿刺技巧。但是徒手植入操作的缺陷在于对医生的临床经验和技术依赖成分较多,并不利于推广普及。而且由于危及器官的阻挡等使得穿刺路径有限且术中需多次扫描CT来调整进针角度和深度,手术时间较长,术者疲惫,影响分布,增加辐射及并发症发生机会。
2. 3D打印模板植入:3D打印(three-dimensional printing)技术,是一种以数字模型文件为基础,运用粉末状金属或塑料等粘合材料通过逐层堆叠累积方式制造三维实体的先进技术,也称为“增材制造”,是新兴的一种快速成型技术[34-35]。目前国内外将3D打印技术主要应用于口腔颌面外科、骨科、神经外科等领域[36]。3D打印模板含有预设插植针道信息和患者治疗区体表特征信息,具备了定位、定向功能,为优化植入方案、推广和规范粒子植入提供了新的方法。由于其可以任意角度进针,有效避开血管、骨骼等,目前已应用于头颈部、肺部、盆腔等部位,取得了较好的疗效[37-39]。2016年国内学者首次对比应用3D打印模板进行术前术后剂量学验证,差异无统计学意义[40],为3D打印模板在粒子植入治疗中的应用提供了一定理论依据。
3. 平面穿刺模板:平面模板可提高穿刺针位置的精准度,克服徒手穿刺的随意性及呼吸运动的影响。有学者应用平面模板引导粒子植入治疗肺癌[41-42],在颈部甲状腺癌中未见应用。
五、放射性碘-125粒子植入治疗甲状腺癌的穿刺路径
甲状腺癌位置表浅,相对于肺、腹盆腔等部位而言,其受呼吸动度、进针深度影响较小,进针深度浅,穿刺针方向更容易控制,穿刺路径灵活多变。从解剖位置分析,甲状腺前方为皮肤、浅筋膜、深筋膜浅层和中层及舌骨下肌群;外侧为颈鞘;后方为颈交感干和4个管道,即喉与气管、咽与食管。穿刺路径的选择应遵循以下原则:穿刺距离最短,规避危及器官,穿刺正常组织最少;针道平行布针;优先选择共面路径。穿刺路径大体分为前方入路、侧方入路:(1)经前方入路时头部应后仰,穿刺路径分别经过皮肤、皮下组织、舌骨下肌群,其中舌骨下肌群包括浅层纵行并列的内侧的胸骨舌骨肌和外侧的肩胛舌骨肌,深层分为上份的甲状舌骨肌和下份的胸骨甲状肌;(2)侧方入路包括左侧入路、右侧入路,患者头偏向一侧,穿刺路径包括皮肤、皮下组织、胸锁乳突肌,因外侧为颈动脉鞘,故穿刺时尤其注意勿损伤血管。
六、粒子植入术前准备
1. 专科病史采集:(1)患者主要症状,如颈部有无疼痛,肿物生长快慢,有无声音嘶哑、呼吸困难以及吞咽梗阻;(2)既往史,患病史和治疗情况。如甲状腺手术史、碘-131治疗情况、内分泌治疗情况,TSH抑制程度、药物不良反应、Tg及Tg抗体变化;(3)检查颈部甲状腺肿块或转移淋巴结非常重要,包括肿块及淋巴结部位、大小、数目、质地、边界、活动度、压痛、与皮肤关系及原有手术瘢痕的走向,颈部是否行气管切开。
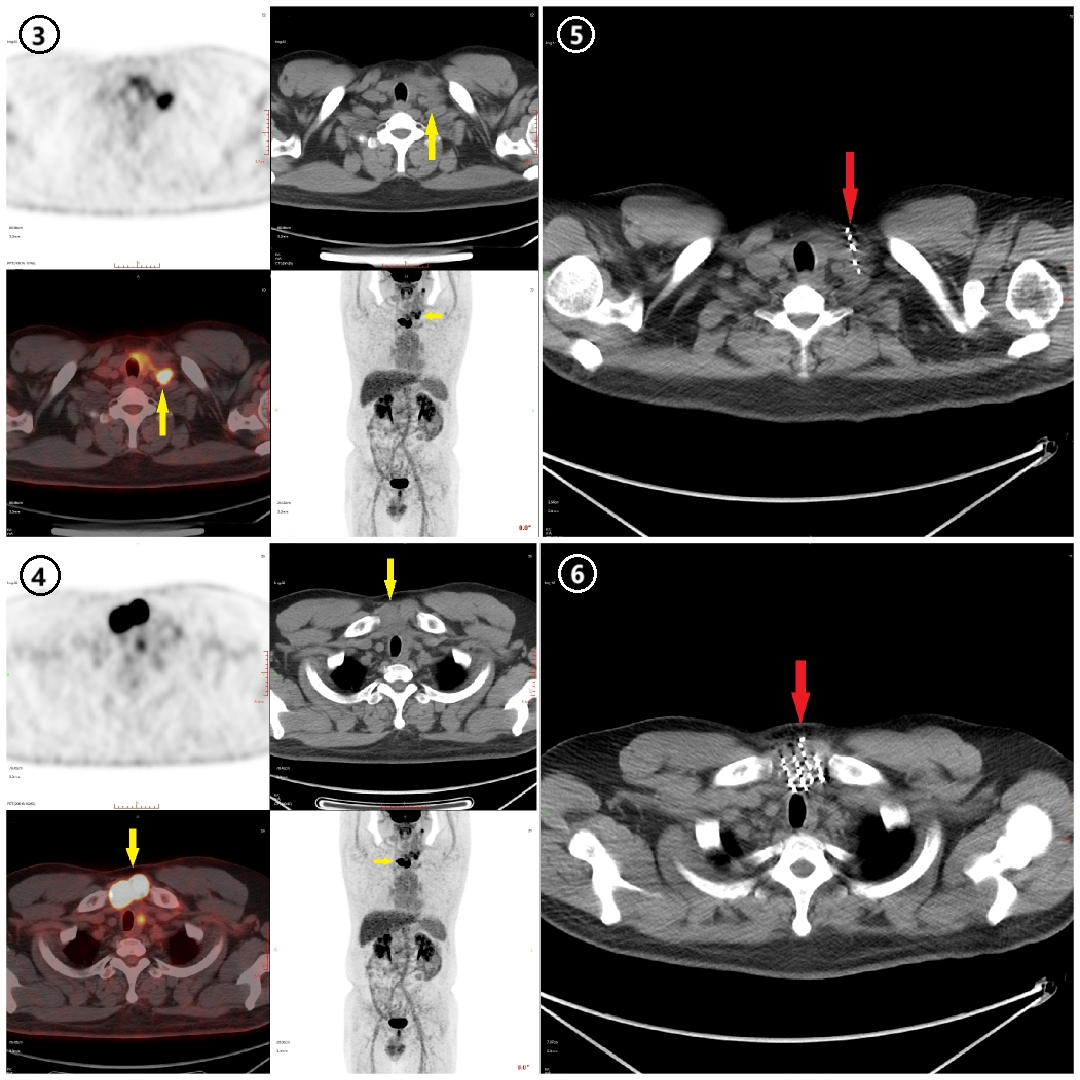
2. 相关检查:(1)实验室检查:血尿便常规、生化全项、凝血功能、肿瘤标记物、甲状腺功能、甲状旁腺激素、降钙素、术前八项、血型等检查;(2)辅助检查:心电图、心脏彩超、肺功能、双下肢动静脉(有无血栓),喉镜;(3)影像学检查:甲状腺及颈部淋巴结彩色多普勒超声检查;头颈部平扫+强化CT,全面评估甲状腺、颈部淋巴结、气管、喉、食管、颈动脉、颈静脉、上纵隔等组织器官是否受侵或偏移,必要时行核磁及正电子发射计算机断层显像(PET-CT)检查。根据肿瘤与气管、食管的关系,决定是否行气管切开及食道造影或胃管置入做标记。
3. 抗菌药物具体应用:粒子植入常多针道并行,且CT引导反复进出。为预防感染,推荐术前0.5 h应用抗生素。革兰阳性球菌是颌面部间隙感染主要检出细菌。链球菌和葡萄球菌是在成人口腔颌面部感染中最常检出的需氧菌,可选用青霉素类、红霉素、林可霉素及头孢菌素类。另外存在于人体皮肤及腔道的深部和黏膜表面,在组织缺血、坏死,或需氧菌感染的情况下,局部组织氧浓度降低,即可发生厌氧菌感染,故常合并应用甲硝唑或奥硝唑。
七、手术流程
1. 术前定位:由专职物理师在粒子植入术前l周用负压真空垫根据手术要求固定患者体位。拟行3D打印模板引导的患者,需在根据CT定位激光线于患者体表作模板复位参考线,并粘贴2~3枚标记点,进行层厚为5 mm的强化CT扫描;拟采用CT引导徒手穿刺植入患者,无需在体表做标记,仅行层厚为5 mm的强化CT扫描即可。定位后的真空负压垫保持原状,留术中备用。
2. 体位选择:术前定位CT体位应与术中体位保持一致,尤其是头枕高度及头偏角度影保持一致。体位的选择应满足穿刺路径的需要,并最大限度地保证患者的舒适度。
3. 制定计划:将CT扫描图像传送至粒子治疗计划系统进行靶区勾画,处方剂量定义和设置危及器官剂量限值。肿瘤靶区(gross tumor volume,GTV):为影像学可见肿瘤区域。临床靶区(cinical target volume,CTV):肿瘤靶区外扩0.5 cm。D90≥处方剂量、V100>95%、V150<100%为计划评价最低要求。若采用3D打印模板,则根据计划设计软件设计出3D打印个体化模板,模板上具有坐标系、固定针和粒子植入针道信息。物理师设计穿刺路径,规避危及器官,布源载入粒子。
4. 粒子抽检:应用放射性活度计,根据国际原子能机构(International Atomic Energy Agency,IAEA)要求,抽样测量10%粒子活度,保证误差在5%之内,消毒备用。
5. 植入粒子:(1)体位复位:若采用3D打印模板,术前需将患者体位用预先定型的真空负压垫完成复位,通过调整患者体位或真空负压垫使CT激光线与患者体表定位线重合。行CT引导徒手穿刺植入者仅需将患者体位用预先定型的真空负压垫固定,使患者体位与定位体位保持一致即可。(2)消毒铺单及麻醉:完成体位复位后,对术区进行消毒、铺单。可根据患者个体情况应用利多卡因(1%或2%)行颈浅丛区域阻滞麻醉。(3)3D模板复位:根据患者体表标记点安放模板,保证模板与患者皮肤贴合紧密,力求使CT激光线、模板定位参考线、患者皮肤定位线三线重合,以完成模板复位。CT引导徒手穿刺植入者无需此步骤。(4)穿刺植入针并植入粒子:若采用3D打印模板,先穿刺模板定位针,扫描CT确认定位针方向与计划一致后,在模板其他预设针道上将植入针穿刺预定深度1/3,同样需注意保证计划共面穿刺路径上针道是否共面,根据实时扫描CT将植入针位置进行微调。确定植入针位置与计划无误后,将植入针全部穿刺到位,根据计划植入粒子,植入完成后,扫描CT,观察粒子在肿瘤内的分布情况,清点粒子数目,根据CT图像行术中实时计划,并将其与计划进行对比,必要时予以补植以满足剂量学要求。若行CT引导徒手穿刺植入者,根据患者术中扫描CT图像,术者确定穿刺针位置,徒手将植入针穿刺入肿瘤,并根据实时CT图像,由物理师结合术前计划,实时指导术者调整针道方向和深度,植入粒子。物理师需实时跟进手术进程,落实植入针和粒子植入位置。(5)术中计划:手术完毕后,物理师应行术中计划进行验证,以便更好地满足剂量学的分布。术中实时计划可及时修正术中因靶区位置及针道位置偏差、粒子位置偏差导致的剂量偏差,随时在实际的穿刺针道上调整粒子的具体位置和数量,使靶区剂量尽可能满足要求,避免出现“冷区”“热区”。同时,术中治疗计划系统(Treatment Planning System,TPS)实时指导还可以避免危及器官超量,特别是对于如食管、皮肤等危及器官,具有重要的指导意义。
八、手术难点
碘-125粒子植入治疗甲状腺癌手术难点主要在于危及器官的处理及活度的选择,应根据靶区周围危及器官的不同及距离选择活度[32]。建议考虑以下因素:(1)靶区体积<5 cm时,推荐将低活度粒子分布于靶区边缘,优势在于粒子初始活度低,随着核素衰变,高剂量区范围及持续时间会进一步缩小,即便拉近粒子与危及器官距离,其影响也会减小,以保证安全。靶区体积>5 cm时,建议将较高活度(>0.5 mCi)粒子分次植入靶区,通过动态观察疗效及剂量学管理决定是否需要补植。(2)靶区与危及器官距离:推荐靶区与危及器官保持0.5 cm的安全距离。当距离>0.5 cm时,可尝试高活度粒子;当距离<0.5 cm时,可尝试低活度粒子。
1. 气管侵犯的处理:颈段气管被甲状腺两叶和峡部覆盖环绕,是局部晚期甲状腺癌容易侵犯的部位,一旦侵犯,可引起呼吸困难。可疑气管腔内侵犯或气道梗阻时,可行纤维支气管镜检查+活组织检查,进一步明确诊断和评估侵犯程度、范围。引起严重呼吸困难,有窒息风险时,应先行气管支架置入或气管切开。若肿瘤造成环状软骨下缘以下梗阻时可考虑行支架植入。肿瘤累及声门引起声门及声门下狭窄(即环状软骨下缘以上水平)是支架相对禁忌证,建议行气管切开。气管套管避免使用金属材质,以减少粒子植入术中金属伪影的影响。气管切开后可将粒子贴气管壁植入,推荐粒子活度0.4~0.5 mCi。
2. 食管侵犯的处理:局部晚期甲状腺癌侵犯食管后可逐渐发展引起吞咽困难、消化道出血。术前可疑食管侵犯,行食管造影或食管镜检查+活组织检查,评估食管侵犯程度和范围,术前常规留置胃管有助于术中辨认食管。如肿瘤距离食管<0.5 cm,粒子需降低活度,推荐采用0.3~0.4 mCi,若肿瘤距离食管0.5~1.0 cm,推荐选取粒子活度0.4~0.6 mCi。
3. 颈部大血管侵犯的处理:如果可疑颈动脉或颈内静脉受侵,行强化CT检查或超声检查,明确血管情况,观察头面部静脉回流情况,避免肿瘤侵犯大血管导致大出血。术中穿刺计划应尽量避免穿刺血管,靠近颈动静脉鞘时需预防感染。如肿瘤距离正常血管<0.5 cm,需降低粒子活度,推荐采用0.4~0.5 mCi;若肿瘤距离正常血管0.5~1.0 cm,推荐选取粒子活度0.5~0.6 mCi。
4. 侵犯皮肤的处理:甲状腺癌单纯侵犯颈部皮肤和肌肉较少见,常导致肿瘤破溃、肿瘤组织坏死,还会使颈部血管、神经、气管、食管等器官暴露,缺少软组织的保护与支撑,造成感染、大出血等风险。如肿瘤侵犯皮肤,甚至造成破溃,可选取粒子活度0.3~0.4 mCi。肿瘤未破溃但伴液化坏死者,推荐液化坏死部位先引流,保持引流通畅并按时换药,然后在肿瘤实性部位分次植入粒子,选取粒子活度0.3~0.5 mCi。
推荐意见4:术前应充分评估气管、食管、颈部大血管、皮肤等危及器官受侵程度。可疑气管侵犯时,需行支气管镜检查,并发严重呼吸困难者,先行气管支架置入或气管切开。可疑食管侵犯时,需行食管造影或食管镜检查,术前留置胃管标记食管位置。可疑颈部大血管受侵,需行强化CT或超声检查。对肿瘤伴液化坏死者,推荐液化坏死部位先引流。(证据级别A,推荐强度1)
推荐意见5:粒子植入术前需评估肿瘤与危及器官距离,靶区与危及器官距离>0.5 cm时,推荐提高粒子活度;当距离<0.5 cm时,降低粒子活度。(证据级别B,推荐强度1)
九、不良反应及并发症
结合美国卫生及公共服务部国立卫生研究院及国家癌症研究所制定的常见不良反应评价标准[43-44]和美国放射肿瘤学研究所(Radiation Therapy Oncology Group,RTOG)制定的放射反应评价标准(RTOG/EORTC1987)[45],对粒子植入后的不良反应和并发症进行评估。
1. 出血或局部血肿:常发生于术中或术后24 h。颈部因穿刺到血管导致的出血一般量较小,主要靠压迫为主,注意拔针即压,用力压实,10~20 min一般可止血。如出血量较大,出现血肿压迫气管导致呼吸困难时应紧急气管插管或气管切开保证呼吸道通畅,同时处理责任血管,密切注意血压、脉搏变化,必要时行介入栓塞止血[46]。
2. 水肿:较常见,发生于术后1~2周。浅表软组织水肿可表现为局部肿胀,颈部憋涨感,咽腔、喉部水肿可导致呼吸困难、喘憋。轻度水肿可于术后1周给予激素治疗,严重水肿导致明显呼吸困难喘憋者应急诊请耳鼻喉科会诊行气管插管或气管切开保证呼吸道通畅[47]。
3. 神经损伤:甲状腺癌粒子植入穿刺或辐射有导致颈部神经损伤的可能,从而出现疼痛异常或感觉异常。最常见为喉返神经损伤,多表现为该神经支配的感觉或运动异常。如靶区对侧声带固定者,手术应特别注意,靶区侧喉返神经损伤有导致窒息的可能。
4. 感染:相对少见,常发生于术后1周内。主要指植入部位的感染,尤其肿瘤位于血管鞘时。表现为术后发热、白细胞数量升高等。可给予抗感染治疗,严格执行无菌操作可降低发生率。
5. 食管瘘、咽瘘和气管瘘:较少见,常于术后2~3个月出现。可能因放射性损伤,也可能因肿瘤侵犯所致,首先禁食,必要时引流按时换药,瘘口常愈合困难。若瘘口感染,应积极抗炎治疗,若感染扩散至大血管旁,需行局部清创处理以防大血管感染出血危及生命。
6. 针道转移:相对少见。有学者提出粒子植入针穿刺肿瘤后植入针表面组织涂片癌细胞阳性率为2.8%~5.2%[48]。可行外科切除或再次行粒子植入,术中经穿刺针注入5-氟尿嘧啶或替加氟等化疗药物可降低发生针道转移的几率。
7. 粒子移位和迁移:放射性粒子在种植术后可能发生移位、迁移或丢失而引起感染、放射热点和冷点、栓塞等并发症[49]。多数原因为术前对肿瘤靶区评估不充分导致,术前应评估靶区质地,在肿瘤实性部位植入粒子,并在术后行动态剂量验证,防治粒子聚集出现剂量热点导致并发症。粒子迁移也可能因将粒子注入血管内部,粒子随血流游走导致。当发现粒子脱落后,立即穿戴铅手套及铅衣,使用长镊子夹起,放入铅罐内,记录发现粒子和放入容器的时间,并将铅罐送核医学科妥善处理。
8. 局部放射性溃疡及纤维化:放射性溃疡常发生于术后1~2个月、肿瘤距离皮肤<0.5 cm,或既往已行外放疗者常见,尤其既往行2程放疗者,表现为局部皮肤放疗反应,轻者色素沉着,严重者皮肤溃疡。建议在外放疗后2~3个月行粒子植入,并适当减少粒子植入处方剂量。治疗可按放疗损伤或烧伤处理,多可愈合。
9. 其他少见并发症:如肺栓塞、空气栓塞、心脑血管意外等,需个别特殊处理,术前患者全身状态评估十分重要。
推荐意见6:碘-125粒子植入治疗甲状腺癌短期并发症包括出血、水肿、感染,远期并发症包括食管瘘、咽瘘和气管瘘、针道转移、粒子移位等。粒子植入术后应长期随访,及时处理并发症。(证据级别B,推荐强度1)
十、随访及疗效评估
1. 随访:术后1个月复查颈部强化CT,之后每3个月复查1次;2年后每6个月复查1次,5年后每年复查1次。每月复查甲状腺功能以及Tg、Tg抗体。肿瘤≥5 cm者,推荐术后半年每月复查CT,行动态剂量验证。
2. 术后局部疗效评估:参考实体肿瘤的疗效评价标准1.1版。
3. 临床疗效评估:在判断局部疗效的基础上,定期随访患者的生存情况,并记录患者1、2、3、5年的生存情况。同时要观察患者生存质量的改善情况(生活质量量表),疼痛缓解情况(疼痛评分评估)等。
综上,碘-125粒子植入治疗甲状腺癌具有疗效确切、安全微创的特点,但粒子植入治疗甲状腺癌还需要考虑患者的既往治疗方式、复发部位、肿瘤大小、合并症、毗邻组织、与重要器官安全距离、复发间隔时间、患者体征、身体一般状况和预期治疗获益等多方面因素,尤其对于存在气管、食管等重要脏器侵犯的患者,不可盲目植入粒子,需严格把握手术适应证和禁忌证,警惕其术后并发症的发生。另外,本共识仅仅作为学术性专家共识对临床起到一定指导作用,不能作为法律依据。鉴于国内外相关研究的飞速发展,相信随着大宗病例、长期随访的前瞻性研究发布,今后本共识的内容会得到及进一步完善。
牵头专家:王娟(河北省人民医院肿瘤一科)
执笔者:王娟(河北省人民医院肿瘤一科);高贞(河北省人民医院肿瘤一科);张宏涛(河北省人民医院肿瘤一科)
参与制定本共识的专家(按姓氏汉语拼音排序):盖保东(吉林大学中日联谊医院胃肠结直肠外科);高飞(中山大学附属肿瘤医院微创介入科);郭金和(东南大学附属中大医院介入与血管外科);高贞(河北省人民医院肿瘤一科);胡效坤(青岛大学附属医院介入医学中心);黄学全(陆军军医大学西南医院微创介入科);焦德超(郑州大学第一附属医院放射介入科);刘宝国(北京大学肿瘤医院头颈外科);李成利(山东大学附属山东省医学影像学研究所影像介入治疗科);雷光焰(陕西省肿瘤医院胸部肿瘤外科);李卫东(沧州市人民医院甲状腺头颈外科);李玉亮(山东大学第二医院介入医学科);刘泽洲(河北省人民医院肿瘤一科);牛洪欣(山东省肿瘤医院介入外科);石峰(中南大学湘雅医学院附属肿瘤医院/湖南省肿瘤医院核医学科);王娟(河北省人民医院肿瘤一科);王若雨(大连大学附属中山医院肿瘤科);王忠敏(上海交通大学医学院附属瑞金医院放射介入科);肖越勇(中国人民解放军总医院第一医学中心放射诊断科);杨辉(河南省肿瘤医院核医学科);叶欣(山东省立医院肿瘤科);张福君(中山大学附属肿瘤医院微创介入科);朱光宇(东南大学附属中大医院介入与血管外科);张宏涛(河北省人民医院肿瘤一科);张建国(北京大学口腔医院口腔颌面外科);张肖(解放军总医院第一医学中心放射诊断科)
利益冲突:
所有作者均声明不存在利益冲突
参考文献(下滑查看):
[1]BrayF, FerlayJ, SoerjomataramI, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. DOI: 10.3322/caac.21492.
[2]SEER Cancer Statistics Review, National Cancer Institute. [2022-05-06]https://seer.cancer.gov/statfacts/html/thyro.html. Accessed Mar 3, 2019.
[3]ZengH, ChenW, ZhengR, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5):e555-e567. DOI: 10.1016/S2214-109X(18)30127-X.
[4]FahiminiyaS, de KockL, FoulkesWD. Biologic and clinical perspectives on thyroid cancer[J]. N Engl J Med, 2016, 375(23):2306-2307. DOI: 10.1056/NEJMc1613118.
[5]SapuppoG, TavarelliM, BelfioreA, et al. Time to separate persistent from recurrent differentiated thyroid cancer: different conditions with different outcomes[J]. J Clin Endocrinol Metab, 2019, 104(2):258-265. DOI: 10.1210/jc.2018-01383.
[6]WangH, FuHL, LiJN, et al. Comparison of whole-body 18F-FDG SPECT and posttherapeutic 131I scintigraphy in the detection of metastatic thyroid cancer[J]. Clin Imaging, 2008, 32(1):32-37. DOI: 10.1016/j.clinimag.2007.07.010.
[7]BroseMS, NuttingCM, JarzabB, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940):319-328. DOI: 10.1016/S0140-6736(14)60421-9.
[8]YooJ, AgbassiC, LochnanH, et al. Cancer Care Ontario thyroid cancer guideline: an endorsement of the 2015 American Thyroid Association Management Guidelines for adult patients with thyroid nodules and differentiated thyroid cancer[J]. Toronto (ON): Cancer Care Ontario, 2017 March 6. Program in Evidence-based Care Guideline No.: 5-13
[9]DavisBJ, HorwitzEM, LeeWR, et al. American Brachytherapy Society consensus guidelines for transrectal ultRASound-guided permanent prostate brachytherapy[J]. Brachytherapy, 2012, 11(1):6-19. DOI: 10.1016/j.brachy.2011.07.005.
[10]WhitmoreWF, HilarisB, GrabstaldH. RETropubic implantation of iodine 125 in the treatment of prostatic cancer. 1972[J]. J Urol, 2002, 167(2Pt 2):981-983; discussion 984. DOI: 10.1016/s0022-5347(02)80318-4.
[11]MohlerJ, BahnsonRR, BostonB, et al. NCCN clinical practice guidelines in oncology: prostate cancer[J]. J Natl Compr Canc Netw, 2010, 8(2):162-200. DOI: 10.6004/jnccn.2010.0012.
[12]NagS, BeyerD, FriedlandJ, et al. American Brachytherapy Society (ABS) recommendations for transperineal permanent brachytherapy of prostate cancer[J]. Int J Radiat Oncol Biol Phys, 1999, 44(4):789-799. DOI: 10.1016/s0360-3016(99)00069-3.
[13]DavisBJ, HorwitzEM, LeeWR, et al. American Brachytherapy Society consensus guidelines for transrectal ultRASound-guided permanent prostate brachytherapy[J]. Brachytherapy, 2012, 11(1):6-19. DOI: 10.1016/j.brachy.2011.07.005.
[14]YangM, YanZ, LuoJ, et al. A pilot study of intraluminal brachytherapy using 125I seed strand for locally advanced pancreatic ductal adenocarcinoma with obstructive jaundice[J].Brachytherapy, 2016, 15(6):859-864.DOI: 101016/j.brachy.2016.05.004.
[15]FengS, WangL, XiaoZ, et al. 125I seed implant brachytherapy for painful bone metastases after failure of external beam radiation therapy[J].Medicine (Baltimore), 2015, 94(31):e1253.DOI: 10.1097/MD.0000000000001253.
[16]王俊杰. 中国大陆地区影像引导介入近距离治疗学发展概述[J].中华放射肿瘤学杂志, 2016, 25(4):301-303.DOI: 10.3760/cma.j.issn.10044221.2016.04.001.
[17]王娟, 高贞, 唐富龙, 等. 125I粒子植入治疗晚期不能切除的分化型甲状腺癌的初步疗效[J].实用肿瘤杂志, 2013, 28(2):193-196.DOI: 10.13267/j.cnki.syzlzz.2013.02.028.
[18]苑德月, 高贞, 杨智杰, 等. 125I粒子植入治疗难治性甲状腺癌的疗效与安全性[J].中华内分泌外科, 2019, 13(4):297-300.DOI: 10.3760/cma.j.issn.1674-6090.2019.04.008.
[19]GaoZ, ZhangH, ZhangL, et al. 3D-printed template-guided 125I seed brachytherapy: a salvage approach for locoregional refractory recurrence of papillary thyroid cancer[J]. Eur Thyroid J, 2021, 10(6):504-510. DOI: 10.1159/000519572.
[20]YuH, ZhangH, GaoZ, et al. 125I seed brachytherapy for refractory loco-regional recurrence of non-anaplastic thyroid cancer[J]. Front Oncol, 2022, 12:773708. DOI: 10.3389/fonc.2022.773708.
[21]中国临床肿瘤学会指南工作委员会甲状腺癌专家委员会. 中国临床肿瘤学会(CSCO)持续/复发及转移性分化型甲状腺癌诊疗指南-2019[J].肿瘤预防与治疗, 2019, 32(12):1051-1079.DOI: 10.3969/j.issn.1674-0904.2019.12.003.
[22]张文文, 郝珊瑚, 王治国, 等. 125I粒子植入治疗131I难治性分化型甲状腺癌淋巴结转移的临床价值[J].中华核医学与分子影像杂志, 2018, 38(1):9-13.DOI: 10.3760/cma.j.issn.2095-2848.2018.01.003.
[23]JiZ, JiangY, TianS, et al. The effectiveness and prognostic factors of CT-guided radioactive I-125 seed implantation for the treatment of recurrent head and neck cancer after external beam radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2019, 103(3):638-645. DOI: 10.1016/j.ijrobp.2018.10.034.
[24]陈恩立, 张宏涛, 刘泽洲, 等. CT引导125I粒子植入治疗头颈部复发转移肿瘤近期疗效的影响因素分析[J].中华核医学与分子影像杂志, 2020, 40(2):93-97.DOI: 10.3760/cma.j.issn.2095-2848.2020.02.006.
[25]刘泽洲, 王娟, 张宏涛, 等. 125I粒子治疗甲状腺癌实际吸收剂量与靶体积变化研究[J].中华内分泌外科杂志, 2022, 16(1):50-53.DOI: 10.3760/cma.j.cn.115807-20211008-00303.
[26]王娟, 张宏涛, 于慧敏. 放射性粒子植入治疗技术动态剂量验证的意义[J].中华医学杂志, 2018, 98(23):1810-1812.DOI: 10.3760/cma.j.issn.0376-2491.2018.23.002.
[27]BeaulieuL, ArchambaultL, AubinS, et al. The robustness of dose distributions to displacement and migration of 125I permanent seed implants over a wide range of seed number, activity, and designs[J]. Int J Radiat Oncol Biol Phys, 2004, 58(4):1298-1308. DOI: 10.1016/j.ijrobp.2003.11.016.
[28]BuesM, HolupkaEJ, MeskellP, et al. Effect of random seed placement error in permanent transperineal prostate seed implant[J]. Radiother Oncol, 2006, 79(1):70-74. DOI: 10.1016/j.radonc.2006.02.001.
[29]JonesS, WallnerK, MerrickG, et al. Clinical cORRelates of high intraprostatic brachytherapy dose volumes[J]. Int J Radiat Oncol Biol Phys, 2002, 53(2):328-333. DOI: 10.1016/s0360-3016(02)02741-4.
[30]李敏, 文鹏, 钱秋琴, 等. 碘-125粒子植入治疗碘难治性分化型甲状腺癌淋巴结转移灶的临床研究[J].中国癌症杂志, 2020, 30(2):122-127.DOI: 10.19401/j.cnki.1007-3639.2020.02.006.
[31]张文文, 郝珊瑚, 王治国, 等. 放射性碘125粒子植入联合锶核素89及云克治疗碘131难治性甲状腺癌骨转移疗效分析[J].临床军医杂志, 2022, 50(1):31-34.DOI: 10.16680/j.1671-3826.2022.01.09.
[32]王娟, 梁岩松, 张宏涛. 活度对腹盆腔肿瘤125I粒子局部治疗剂量学影响探讨[J].中华医学杂志, 2020, 100(41):3204-3206.DOI: 10.3760/cma.j.cn112137-20200301-00522.
[33]张宏涛, 于慧敏, 郭利涛, 等. 不同活度125I粒子植入后不同时间肿瘤吸收剂量对比[J].介入放射学杂志, 2016, 25(3):243-246.DOI: 10.3969/j.issn.1008-794X.2016.03.014.
[34]蒋明辉, 蔡立宏, 雷青, 等. 3D打印技术在骨科临床的应用研究及展望[J].中华损伤与修复杂志(电子版), 2016, 11(4):288-290.DOI: 10.3877/cma.j.issn.1673-9450.2016.04.011.
[35]左威, 朱睿, 程黎明. 3D打印技术在脊柱外科的应用进展[J].中华实验外科杂志, 2016, 33(7):1873-1876.DOI: 10.3760/cma.j.issn.1001-9030.2016.07.055.
[36]李振化, 王桂华. 3D打印技术在医学中的应用研究进展[J].实用医学杂志, 2015, (7):1203-1205.DOI: 10.3969/j.issn.1006-5725.2015.07.055.
[37]张颖, 林琦, 袁苑, 等. 3D打印个体化模板联合CT引导碘-125粒子植入治疗肿瘤术前术后剂量学比较[J].山东大学学报医学版, 2017, 55(2):45-49.DOI: 10.6040/j.issn.1671-7554.0.2016.1238.
[38]曲昂, 王俊杰, 姜玉良, 等. 3D打印非共面模板与共面坐标模板辅助放射性粒子植入治疗盆壁复发妇科肿瘤的术前计划对比[J].中华医学杂志, 2019, 99(11):841-843.DOI: 10.3760/cma.j.issn.0376-2491.2019.11.009.
[39]曲昂, 孙海涛, 姜伟娟, 等. 剂量学参数对CT引导125I放射性粒子植入治疗放疗后盆腔复发宫颈癌疗效的影响[J].中华医学杂志, 2018, 98(37):3014-3016.DOI: 10.3760/cma.j.issn.0376-2491.2018.37.013.
[40]张宏涛, 底学敏, 于慧敏, 等. 3D打印模板引导125I粒子植入术前术后剂量对比[J].中华医学杂志, 2016, 96(9):712-715.DOI: 10.3760/cma.j.issn.0376-2491.2016.09.010.
[41]柴树德, 郑广钧, 毛玉权, 等. CT引导下经皮穿刺种植放射性125I粒子治疗晚期肺癌[J].中华放射肿瘤学杂志, 2004, 13(4):291-293.DOI: 10.3760/j.issn:1004-4221.2004.04.013.
[42]霍彬, 王磊, 王海涛, 等. 模板联合肋骨钻孔技术辅助放射性粒子植入治疗肺癌的可行性[J].山东大学学报(医学版), 2017, 55(2):26-31.DOI: 10.6040/j.issn.1671-7554.0.2016.1451.
[43]NathR, BiceWS, ButlerWM, et al. AAPM recommendations on dose prescription and reporting methods for permanent interstitial brachytherapy for prostate cancer: report of Task Group 137[J]. Med Phys, 2009, 36(11):5310-5322. DOI: 10.1118/1.3246613.
[44]KluetzPG, ChingosDT, BaschEM, et al. Patient-reported outcomes in cancer clinical trials: measuring symptomatic adverse events with the National Cancer Institute′s Patient-Reported Outcomes Version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE)[J]. Am Soc Clin Oncol Educ Book, 2016, 35:67-73. DOI: 10.1200/EDBK_159514.
[45]TrottiA, PajakTF, GwedeCK, et al. TAME: development of a new method for summarising adverse events of cancer treatment by the Radiation Therapy Oncology Group[J]. Lancet Oncol, 2007, 8(7):613-624. DOI: 10.1016/S1470-2045(07)70144-4.
[46]MengJ, WangX, ZhuangQW, et al. Clinical effectiveness of 125I-seed implantation in combination with nimotuzumab therapy for the advanced oral carcinoma: preliminary results[J]. Eur Rev Med Pharmacol Sci, 2014, 18(21):3304-3310.
[47]MaoMH, ZhangJG, ZhangJ, et al. Postoperative [¹²?I] seed brachytherapy in the treatment of acinic cell carcinoma of the parotid gland: with associated risk factors[J]. Strahlenther Onkol, 2014, 190(11):1008-1014. DOI: 10.1007/s00066-014-0668-3.
[48]王娟, 公维宏, 范会革, 等. 放射性粒子植入术针道医源性肿瘤种植转移的临床观察[J].中华放射肿瘤学杂志, 2007, 16(4):253-254.DOI: 10.3760/j.issn:1004-4221.2007.04.017.
[49]刘晓丽, 张宏涛, 王泽阳, 等. 125I粒子游走的研究现状[J].介入放射学杂志, 2019, 28(6):595-598.DOI: 10.3969/j.issn.1008-794X.2019.06.021.